仿制药和生物类似药在美上市难度有望降低 ——浅析美国2023年患者平价处方法案
- 2024-09-10 17:14
- 作者:黄丽君
- 来源:中国医药报
今年7月11日,美国参议院通过了一项名为Affordable Prescriptions for Patients Act of 2023的法案(即《2023年患者平价处方法案》,以下简称S.150法案)。
S.150法案的主要目的是遏制行为不当者(主要为原研药厂)利用专利策略阻止仿制药或生物类似药上市的反竞争行为。法案最终目的是为仿制药和生物类似药进入市场提供便利,进而降低药品价格。
基本概念
S.150法案开宗明义的目的是“修订《联邦贸易委员会法》以禁止产品跳转及其他目的”(To amend the Federal Trade Commission Act to prohibit product hopping, and for other purposes)。要深入理解S.150法案,“产品跳转”和“专利舞蹈”是需要先行理解的概念。
关于“产品跳转”(Product Hopping)
相对于“产品跳转”,“Evergreening”(专利长青)或“Line extension”(专利延长)似乎是制药行业更为耳熟能详的词汇。“产品跳转”是制药行业比较特殊的一种现象,指原研药企通过改变原研药的配方或剂型(但该等改变并非实质性改变,对药物的疗效并无实质性改进或提高),并鼓励医生为患者开具改变后配方或剂型的处方,让患者放弃“旧药”,转而服用“新药”,以避免“旧药”与仿制药或生物类似药的直接竞争,进而实质维持药品的高价格。
根据原研药企是否从市场上完全撤回“旧药”,业界将“产品跳转”又划分为“柔性跳转”(soft switch)和“强制跳转”(forced switch)。“柔性跳转”的典型特征是通过推销或临时折扣等方式,说服医生开具“新药”处方,但市场上“旧药”依然具有可及性。“强制跳转”是指原研药企从市场上完全撤回面临仿制药或生物类似药竞争的“旧药”,即“旧药”不再具有可及性。当“旧药”的市场保护期到期、仿制药或生物类似药上市时,患者已很难转用价格更低的仿制药或生物类似药。
关于“专利舞蹈”(Patent Dancing)
2010年3月,美国前总统奥巴马签署了医疗改革法案《患者保护与平价医疗法案》(Patient Protection and Affordable Care Act, PPACA),《生物药价格竞争与创新法案》(Biologic Price Competition and Innovation Act, BPCIA)是其中的一部分。
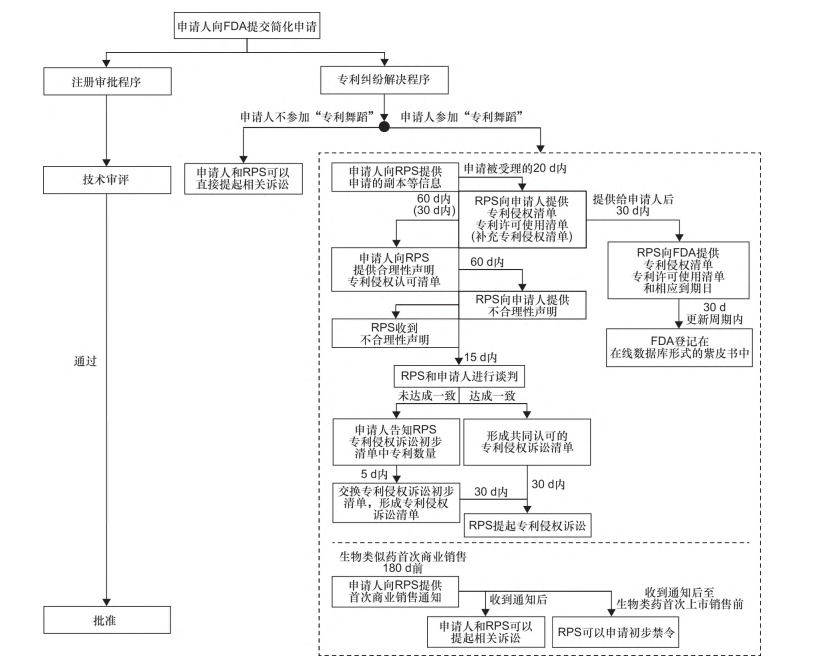
BPCIA是与生物类似药最密切相关的法案,其中提出的一项关键内容是推行生物类似药上市注册申请中的“专利舞蹈”制度,并作为《公共健康服务法案》(Public Health Service Act, PHSA)的组成部分汇编入《美国法典》(United States Code)第42编,即:生物类似药申请人和其参比制剂提供商(即原研药企)应当在药品注册审评过程的早期介入并解决生物类似药专利纠纷问题。在这一过程中,原研药企和生物类似药申请人之间会经历一系列的信息交换及确认过程。在此过程中,原研药企和生物类似药申请人之间将会经历多轮信息互换,业内通常将这一过程形象地称为“专利舞蹈”(详见图)。
现行法律对原研药企在“专利舞蹈”期间主张的专利数量没有限制,这导致一些原研药企滥用专利权利,以推迟生物类似药进入市场的时间。
S.150法案的主要内容
截至目前,美国并没有针对产品跳转的专门立法,公布的S.150法案中也并未具体写明如何修订《联邦贸易委员会法》。
针对“产品跳转”
虽然S.150法案明确了“修订《联邦贸易委员会法》以禁止产品跳转及其他目的”,但该法案并没有明确联邦贸易委员会(Federal Trade Commission,FTC)的作用,也没有包含对《联邦贸易委员会法》的修订,而是对《专利法》和《公共健康服务法案》的修正案。
结合该立法目的,笔者猜测,S.150法案通过后,《联邦贸易委员会法》可能也会随之修改。
针对专利数量
S.150法案试图针对《美国专利法》(Title 35, U.S. Code)第271条(e)款及BPCIA架构下专利诉讼程序中可主张的专利数量进行修订,以限制原研药企在诉讼中可主张的专利数量(不超过20件),特殊情形下法院可以增加争诉专利数量。
BPCIA实施以来,生物类似药上市申请过程中,在“专利舞蹈”程序期间,鲜少有原研药企主张的专利超过20个;在美国食品药品管理局(FDA)已经批准的生物类似药中,即使原研药企在首轮专利信息清单中给出的专利超过20个,在之后形成的达成共同认可的专利侵权诉讼清单中也未有原研药企主张超过20个专利。因此,针对专利数量的限制,本文不作深入讨论。
“产品跳转”的典型案例
在美国法域内,目前没有针对“产品跳转”进行专门的立法,“产品跳转”的案件通常在反垄断法的视野下进行审查。
案例一 Tricor案
双方:Abbott Laboratories(雅培) V. Teva Pharmaceuticals USA, Inc.(梯瓦)
案例事实:1998年,雅培申报的Tricor(酮康唑)胶囊获得FDA的新药上市申请(NDA)批准。两家药企Novopharm和Impax分别在1999年和2000年向FDA提交了该药的简化新药申请(ANDA),并声称其配方不侵犯专利。雅培提起诉讼,触发了30个月遏制期。最终法院判决仿制药不侵犯专利。
在诉讼期间,雅培提交了新的54mg和160mg片剂配方的NDA,获得批准后即停止了Tricor胶囊的销售,并从药店回购了胶囊剂型。2002年,Teva和Impax两家药企分别开发了该54mg和160mg片剂的仿制药并提交了ANDA。雅培再次提起诉讼,并在诉讼期间提交了新的48mg和145mg片剂配方的NDA。Teva根据《谢尔曼法》和州法律提起诉讼,指控原研药企雅培两次改变Tricor药物的配方,以阻止仿制药进入市场,并在没有正当理由的情况下提起专利侵权诉讼。法院发现,雅培的行为包括改变剂量和配方,但没有显著的治疗改进,其目的是延迟仿制药的上市并维持垄断利润。
法院认为:被告的行为阻止了仿制药通过成本效益(cost-efficient)较高的方式竞争(并不要求达到排他性的程度),对市场竞争产生了负面影响,也加剧了价格脱节现象(price disconnect),使得消费者无法获得价格更低的仿制药。由此认定被告的行为构成了反竞争行为,违反了反垄断法。
案例二 Prilosec案
双方:Walgreen Co. (沃尔格林)V. AstraZeneca Pharmaceuticals(阿斯利康)
案件事实:阿斯利康是Prilosec(奥美拉唑)的原研药企,剂型为胶囊。在Prilosec专利即将到期之前,阿斯利康非实质性改变了配方,开发出新药Nexium,并在FDA获得了NDA批准。Nexium上市后,阿斯利康并未将Prilosec移出市场,只是停止促销Prilosec,同时积极向医生推销Nexium。沃尔格林认为阿斯利康的行为扭曲并误导了市场竞争。
法院认为:阿斯利康在其Prilosec专利即将到期时推出Nexium的行为,实际上是增加了而非减少了消费者的选择,因为患者可以选择两种药物同时使用,Prilosec药品本身并没有从市场上被移除;专利本质上是允许排他性使用的权利,故不构成排他性行为;决定哪种产品更优是市场的事,新产品不会影响竞争对手的市场份额,除非消费者更喜欢新产品,故不存在反垄断损害。
案例三 Suboxone案
所涉企业:Reckitt Benckiser(利洁时)
案件事实:利洁时在其治疗阿片类药物依赖的Suboxone(美沙酮)片剂药品专利即将到期时,推出新的Suboxone膜剂药品。利洁时被指控因虚假的安全隐患公开宣布即将移除Suboxone片剂,但在6个月后(即仿制药获批时)才真正移除,并提高片剂相对于膜剂的价格,即使膜剂的制造和包装成本更高。
用于阿片类药物依赖性治疗的处方药直接购买者和最终付款人起诉该药的制造商及其关联公司,指控利洁时将Suboxone从片剂转为膜剂阻碍了仿制药竞争,声称其违反了联邦和州的反垄断法。
法院认为:利洁时在Suboxone市场中占有显著的市场份额,并且存在高进入障碍,表明其具有潜在的垄断力量。原告提供的证据显示 ,利洁时有意通过虚假安全担忧和市场撤回等反竞争手段,限制仿制药进入市场。
法院还认为,判断行为是否具有排他性不是基于完全封锁,而是是否严重限制了市场,从片剂到膜剂的“产品跳转”可能迫使消费者从片剂转向膜剂,足以构成排他性行为。
案例四 Doryx案
双方:Mylan Pharmaceuticals Inc. (迈兰) V. Warner Chilcott Public Limited Company
案件事实:Doryx是Warner Chilcott开发的缓释型多西环素氯化物,用于治疗严重痤疮。Warner Chilcott被指控采取了一系列行为阻止仿制药的竞争,包括:对Doryx进行各种外观和剂量上的细微改动,停止向批发商销售Doryx胶囊,从网站上移除胶囊信息,与零售商合作自动推荐片剂,回购、销毁胶囊库存等。仿制药生产商迈兰对Warner Chilcott提起诉讼,指控其排除仿制药的竞争,违反了《谢尔曼法》。
法院认为:Doryx与其他治疗痤疮的口服四环素类药物之间存在高度的产品互换性和需求交叉弹性,这些都不利于垄断力量的生成,原研药企在相关市场不具有垄断能力(市场份额未超过18%),因此没有违反《谢尔曼法》制造垄断。因而,原研药企的“产品跳转”行为,并未将仿制药制造商排除在市场之外,并非《谢尔曼法》所禁止的反竞争行为。
法院同时指出,采用原告的理论可能会带来不利的、意想不到的后果,可能会减缓甚至停止制药行业的创新。如果每次公司重新配制原研药物都可能引发昂贵且不确定的诉讼,这会增加成本,阻碍制造商改进现有药物。
案例五 Namenda案
双方:New York ex rel. Schneiderman V. Actavis PLC
案件事实:Namenda IR是一款用于治疗中度至重度阿尔茨海默病的药物,每日两次用药。原研药企Actavis在Namenda IR专利保护期即将结束时,推出Namenda XR (每日1次版本),并计划撤销Namenda IR。纽约州政府对Actavis提起反垄断诉讼,声称这一举措具有反竞争的性质,将妨碍仿制药的竞争,违反了《谢尔曼法》和州Donnelly法案。
法院认为:产品撤回或产品改进本身并不属于反竞争,但当垄断者将产品撤回与其他行为相结合,总体效果是强迫而非说服消费者并阻碍竞争时,其行为违反了《谢尔曼法》。Actavis在没有合理商业理由的情况下,计划从市场上撤回一种成功的每日两次用药的阿尔茨海默病治疗药物,并引入一种重新配方的每日1次用药版本,将违反《谢尔曼法》的反垄断条款。
法院还授权发布初步禁令,禁止Actavis在仿制药竞争对手进入市场30天后的之前从市场上撤回每日两次用药的版本。
上述五个案件均是在典型反垄断法框架下进行的法律分析和论证:界定相关市场、市场效率、消费者利益。如果S.150法案“一刀切”地禁止“产品跳转”行为,那么《谢尔曼法》对医药行业“产品跳转”行为的适用或受影响,FTC对从事各种形式“产品跳转”的原研药企提起诉讼并取得胜诉的能力也可能会加强。
从简单逻辑来看,S.150法案通过,将在短期内减少患者对于处方药的经济负担,但市场经济受多种复杂因素影响,尤其是对创新高度依赖和敏感的医药行业,药品价格下降对创新激励机制或有影响,并最终影响患者的健康利益。法案对市场和行业的影响,只有时间能够验证。
S.150法案对美国药企的可能影响
影响一 FTC针对实施“产品跳转”行为的原研药企诉讼的胜诉概率将大为提高
S.150法案通过后,原研药企的“产品跳转”行为在常规情形下,将被法律施以负面评价,特殊情形下才可能是被豁免的。这可能会改变目前在反垄断法视野下对“产品跳转”进行经济学以及是否具有反竞争效果进行分析的框架和逻辑。
联邦贸易委员会(FTC)也将拥有更大权力,针对实施产品跳转行为的原研药企提起诉讼,其取得胜诉的概率也将大大提高。
影响二 生物类似药将加速进入市场
艾伯维围绕原研药阿达木单抗(修美乐)构建的专利丛林,使其在生物药领域收获了丰厚的回报:修美乐是全球销售额最高的生物药之一,在其上市后的20多年时间里,为艾伯维累计带来超过2000亿美元的收入。在美国,修美乐的基础专利于2016年即到期,但艾伯维围绕修美乐构建了超过100件的专利丛林,以阻止生物类似药进入市场。
2019年,生产阿达木单抗生物类似药的药企起诉艾伯维,指控其专利丛林违反了反垄断法。美国第七巡回法院认为,美国专利法没有针对专利丛林的数量进行限定,一些TMT行业内的科技公司拥有的专利要远远多于生物药的专利丛林。
按照S.150法案的条款(专利诉讼程序中可主张的专利数量不得超过20个),对于类似修美乐这样构建了专利丛林的原研药,在反垄断法的视野下可能会有不一样的结论。
可以预见,生物类似药进入市场的速度可能将大大加快,市场竞争将加剧,在充分竞争下,药品的价格将下降,药品的可及性将提高。
影响三 原研药企的专利策略可能会改变
原研药企通过专利长青策略,采用微小、非实质性改进,以变相延长专利保护期的难度将加大。
因此,原研药企要通过实质性的研发投入,以达到非微小的、实质性的改进,并在此基础上进行专利保护,而不仅仅是进行专利的策略性布局。
S.150法案对中国生物医药行业的可能影响
影响一 利好中国生物类似药出口企业
S.150法案施行后,生物类似药在美国获批上市的难度将总体降低。但S.150法案对专利法的影响为何,还有待实践检验。S.150法案对产品跳转进行负面评价,并不意味着原研药企不可以继续申请专利,在美国法域内经过法定程序获得的专利权依然是有效的,专利权的权能并未受到限制,这一点需要相关企业予以关注。
影响二 对国内生物医药企业的创新能力要求更高
今年上半年,中国生物医药企业的出海呈现“多点开花”现象:创新药、生物类似药、疫苗、医疗器械等细分赛道均有产品实现在包括美国在内的海外获批。
美国的医药市场规模和市场价值在全球医药市场中均居于重要地位。S.150法案正式通过后,短期内,对以创新药进入美国的中国生物医药企业可能不产生实质影响。其原因在于,最早一批进入美国市场的中国创新药还未到达基础专利的权利终止日,还无需考虑是否“产品跳转”以及如何跳转的商业战略。但基础专利的权利终止是一定会发生的,如何延续进入美国市场的中国创新药的市场寿命,是中国创新药企业必须面临的问题。
以真正意义的全球首创、全球最优来衡量,即使中国最优秀的一批生物医药企业已经将自主研发的创新药推向了美国市场,其仍然有很长的路要走。S.150法案本质上并不鼓励未对药品的疗效有实质提升的微小创新或细微改动,这对所有的生物医药企业(当然包括进入美国市场的中国生物医药企业)的创新提出了更高要求。
全新靶点、最优效果这一高度的创新,需要基础科学和医药产业共同携手。在美国,以NIH为代表的政府机构资助了大量生命科学领域的基础研究,同时为小微企业提供早期应用研究基金。2007年和2009年,NIH的STTR计划资助的2个研究项目,研发出“含有修饰核苷的RNA及其使用方法”等技术,为基于mRNA的新冠病毒疫苗成功上市奠定了基础。美国的大学在生命科学领域的创新体系中发挥了关键作用。大学一方面在政府或各种社会基金的资助下进行基础科学的研究;另一方面他们以自身为中心,将基础理论和技术传播给深具市场活力的企业,企业也获益于大学的基础理论和技术传播,并反哺大学,仅2017年,美国的生物医药公司就向美国的大学提供了超过25亿美元的研究资金。此外,美国大型医药公司和创新医药企业的合作已经成为习惯,并形成了非常成熟的合作机制和价值实现路径:创新医药公司将自身更高的研发效率与大型医药公司雄厚的资金实力、临床开发经验和能力、大规模生产能力、注册能力和广泛的销售网络结合,实现商业利益最大化。
S.150法案获批后,已经进入美国市场的中国生物医药企业为巩固并提升其在美国市场的竞争力及产品的市场占有率有两种可能的选择。一是深植中国本土,在中国生命科学领域的创新系统中,整合上游的基础科学研究和市场中的创新主体,将两者的优势导入自身管线,在美国市场不断推出更优药品,以创新获得市场回报。二是快速融入美国生命科学领域的创新系统,快速适应这一系统的规则和路径,在美国市场按照美国规则和模式不断夯实提升自身研发实力,丰富自身管线。
(作者:环球律师事务所 黄丽君)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

我与《药品管理法》征文 | 杨勇:甘当药事法治建设道路上的追随者
2001年9月,正值西安交通大学药学院杨世民教授开设《药事管理学》课堂,我与第一次修订颁行的《中华人民共和国药品管理法》如期而遇,也从此开启了自己执着追随的研法、普法、育人、助人之路。 2024-11-26 10:26 -

强化证据研究 提高行政办案水平 ——浅议证据关联性判断在药品行政处罚中的适用
行政执法人员在办理药品行政处罚案件时,如何判断证据是否与案件中的相关违法事实或其他需要证明的事项具有关联性呢? 2024-11-26 10:23
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有