肿瘤免疫治疗明星药——抗PD-1/PD-L1 单克隆抗体
- 2018-11-19 15:05
- 作者:赵新汉
- 来源:中国食品药品监管杂志
编者按
药品安全关系到人民群众的健康和生命,是重大的民生问题。每年举办的“全国安全用药月”活动,旨在通过活动搭建平台,传播安全用药科学理念和实用知识、宣传医药领域最新技术成果、宣贯相关法规政策等。今年的“全国安全用药月”,本刊特别邀约《实用临床药物学》一书的三位临床和药理学专家,就他们各自研究领域,对目前研究热点肿瘤免疫治疗明星药抗PD-1/PD-L1 单抗、临床各科常用的降压消肿利尿剂及未来药物研发方向基因组学在药物个体化治疗中的应用,做了专业的科普解读,期望通过专家解读,引起全社会对安全用药的了解和关注。

目前肿瘤治疗药物中最闪耀的明星无疑是免疫治疗中的抗PD-1/PD-L1 单抗。由于抗PD-1 单抗Pembrolizumab 成功地使美国前总统卡特的黑色素瘤脑转移完全缓解, 一时名声大噪,被称为“总统药”。抗PD-1/PD-L1 单抗还使部分无药可救的晚期癌症患者能获得长达5 年甚至10 年以上的生存期,为患者的重生带来了新的曙光,被坊间冠于“ 神药” 之称。2013年《Science》将其评选为当年全球十大科学研究突破之首[1]。PD-1/PD-L1 单抗的发展可谓是突飞猛进、日新月异。2006 年开始做第一项临床研究,2014 年7月正式获批上市, 到目前为止,短短4 年时间已经有5 个抗PD-1/PD-L1 单抗、几十个适应证获批,上百个抗PD-1/PD-L1 单抗、上千项临床研究在研。本文简要介绍一下抗PD-1/PD-L1 单抗作用机制、目前进展、不良反应及应对措施等。
1. 什么是PD-1/PD-L1
PD-1( programmed death protein 1),全称为程序性死亡受体1,是一个非常重要的免疫检查点(Immune checkpoint),属于B7-CD28 受体超家族成员。其最初是日本京都大学Tasuku Honjo 教授1992 年在The EMBO Journal 发表的文章首次报道,认为激活PD-1 可能会引起程序性死亡[2]。不过限于当时的认知和细胞凋亡如火如荼开展的时代背景,PD-1 的发现在很长一段时间内并没有得到太多重视。PD-1 是一个可被诱导表达的蛋白,即T 细胞在未被激活的时候是几乎没有表达的,只有在T 细胞活化之后,PD-1 才会被诱导表达。除了在活化成熟的T细胞上有表达,PD-1 还在B 细胞、NK 细胞、DC 细胞及部分肿瘤细胞中有表达。
1999 年,华裔教授陈列平在Nature Medcine 发表文章报道了B7 家族的第三个成员B7-H1, 即PD-1 的配体之一PD-L1(programmed deathligand 1)[3]。2001 年, 美国Gordon Freeman 在Nature Immunology 又率先报道了PD-1 的另一个配体PD-L2[4]。PD-L1 和PD-L2 两者都属于B7 配体家族,有34% 的同源性,为什么有抗PD-L1 单抗“神药”,却没有抗PD-L2 单抗“ 神药”呢?那是因为PD-L1 和PD-L2两者之间有很大差异,首先表达载体不一样,PD-L1 在成熟的CD4+、CD8+T 细胞及B 细胞、树突细胞、巨噬细胞、间充质干细胞以及非造血细胞等多种细胞中均有表达,在多种肿瘤细胞如黑色素瘤、肺癌、尿路上皮癌、头颈部鳞癌等高表达,而PD-L2的表达范围较窄,主要表达于B细胞。此外,两种配体与PD-1结合的亲和力也有差异,PD-L2对PD-1 的亲和力是PD-L1 的3~4 倍, 也即PD-L1/PD-1 解离率为PD-1/PD-L2 的3~4 倍。鉴于这些差异,目前针对肿瘤免疫治疗信号通路的研究主要集中在PD-1/PD-L1 相互作用上。
PD-1/PD-L 通路不仅在我们所熟知的抗肿瘤方面扮演重要角色,同时在抗感染、抗自身免疫性疾病及器官移植存活等方面亦有重要意义。
2. 抗PD-1/PD-L1 单抗如何抗击肿瘤
与既往的传统治疗如化疗、放疗及靶向治疗等直接杀伤肿瘤细胞不同, 抗PD-1/PD-L1 单抗是通过作用于免疫系统间接杀伤肿瘤细胞。在人体的免疫系统中,有一种重要的免疫细胞叫作T 细胞,就像是身体的卫士,在外界有害物质入侵机体时,T 细胞通常会诱发免疫反应,从而消灭异物。但是为了避免过度活跃的免疫反应对健康组织也造成损害,免疫系统进化出一套复杂的调节机制。在T 细胞的表面上存在着两类蛋白,一类在受到刺激后会引起免疫反应, 另一类在受到刺激后会抑制免疫反应,PD-1、PD-L1 就属于这类负性调控分子,好比免疫的“刹车”系统。活化的T 细胞上的PD-1与抗原递呈细胞上的PD-L1 一旦暗号对接成功,免疫细胞就认为“没有异常”,于是便不会发动攻击。这本是机体维持自身平衡的一种正常机制。但肿瘤细胞就像体内的叛徒,在与免疫系统的斗争过程中破解免疫系统的这套暗号,于是通过过度表达PD-L1来武装自己,迷惑了T 细胞,使肿瘤微环境中PD-1/PD-L1 通路持续激活,抑制人体免疫系统反应,逃避免疫监视与攻击,最终成功逆袭,不断增殖发展壮大,如图1[5]。
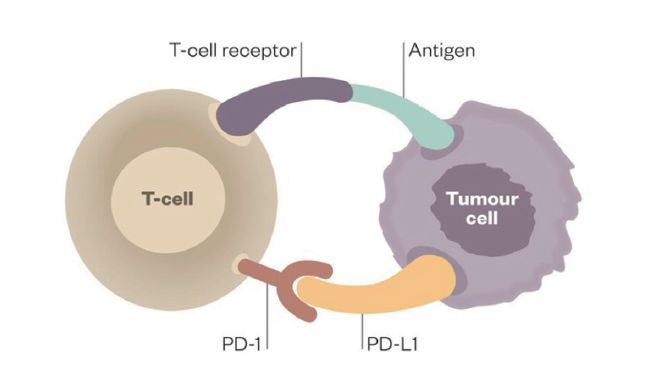
图1 T 细胞PD-1 与肿瘤细胞PD-L1 结合,抑制T 细胞功能,癌细胞逃避免疫攻击
图片来源:Malini Guha. The new era of immune checkpoint inhibitors. Pharm.J.2014,18:1-9.
在这种情况下,全世界的科学家经过数十年艰苦卓绝的不懈奋斗,终于找到了应对的策略,那就是将PD-1 与PD-L1 对接的通路封闭,因此针对PD-1 或PD-L1 设计特定的蛋白质抗体,即抗PD-1 或PD-L1 单抗, 使免疫系统“刹车”松开,这时T细胞的活性就得以恢复,可以识别出隐藏在面具下的叛徒,最终将肿瘤细胞成功围剿,如图2[5]。
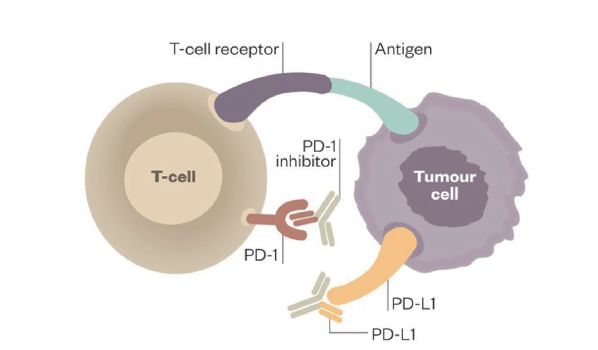
图2 抗PD-1/PD-L1 单抗解除PD-1/PD-L1 的结合,恢复T细胞活性
图片来源:Malini Guha. The new era of immune checkpoint inhibitors. Pharm.J.2014,18:1-9.
3. 抗PD-1/PD-L1 单抗研究进展
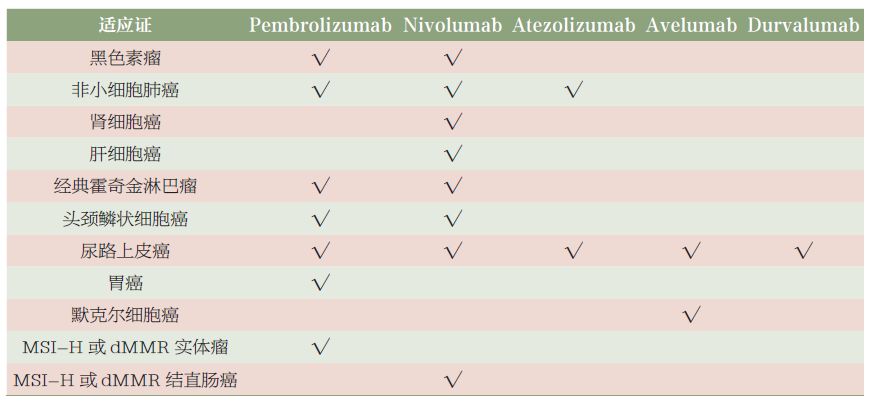
抗PD-1/PD-L1 单抗从最初的双蚌相争,到三分天下,而后发展成四大金刚, 现在俨然已是五朵金花。目前国外已有5 种抗PD-1/PD-L1 单抗上市,包括2 种抗PD-1 抗体,即Nivolumab( 商品名Opdivo)和Pembrolizumab( 商品名Keytruda),3 种抗PD-L1 抗体, 即Atezolizumab( 商品名Tecentriq)、Avelumab( 商品名Bavencio)和Durvalumab(商品名Imfinzi),获批的适应证涵盖十几个瘤种(见表1)[6]。其中处于领先地位的是Nivolumab 和Pembrolizumab。根据吴一龙教授牵头的CheckMate 078 研究结果,我国在2018 年6 月15 日迎来了第一个抗PD-1 单抗药物Nivolumab 的上市,国家药监局批准的适应证为二线治疗非小细胞肺癌(NSCLC)。这标志着我国NSCLC 也迈入了免疫治疗新时代。
表1 FDA 批准的抗PD-1/PD-L1 单抗适应证
3.1 非小细胞肺癌(NSCLC)
肺癌发病率位居癌症首位, 是医药产业必争之地, 不断上演着一场场精彩绝伦的商业大战。2015 年,Nivolumab的CheckMate 017 研究( 鳞癌)、CheckMate 057 研究(非鳞癌) 都获得了阳性结果, 疗效碾压标准治疗多西他赛, 将生存期延长了约3 个月, 奠定了Nivolumab 二线治疗的地位。同样在2015 年,Pembrolizumab根据KEYNOTE-001 研究的数据,被批准PD-L1 阳性晚期NSCLC 的二线治疗,然而,与Nivolumab 定位策略不同的是,Pembrolizumab 将目标人群锁定在PD - L1 阳性的患者,同时发现PD-L1 高表达人群(PDL1≥ 50% ) 疗效更好。在二线全面获得成功后,就开始进军角逐一线。Nivolumab 为了扩大市场,采取了比较大胆的策略,入组人群是PD-L1 阳性的患者,然而让人猝不及防的是CheckMate 026 研究结果未达到预期目标。CheckMate 026 的失败让BMS公司股价大跌,市值缩水200 多亿。不过这也给研究者及肿瘤医师敲了一记警钟, 抗PD-1/PD-L1 单抗并非万能神药,需要筛选出能获益的优势人群才能确保研究的成功。BMS 后来找到了一个让Nivolumab 在肺癌一线绝处逢生的武器:肿瘤突变负荷(Tumor mutation burden,TMB)。对CheckMate 026 研究事后分析显示,TMB 高的患者Nivolumab 的疗效较化疗延长无进展生存期将近4 个月。近期公布的CheckMate 227 研究同样证实了Nivolumab 联合Ipilimumab 或Nivolumab 联合化疗在TMB 高的患者疗效优于单用化疗, 而在TMB 低的患者中, 三种方案疗效并无差异。反观Pembrolizumab 在一线治疗走的更加谨慎,在筛选人群方面标准更为严格, 入组患者PD-L1 表达需≥ 50%, 最终KEYNOTE-024 研究取得了阳性结果。在PD-L1 高表达的患者中,Pembrolizumab 的疗效明显优于含铂双药化疗,2016年获批用于PD-L1 高表达患者的一线治疗,成功实现了弯道超车。为更进一步扩大适应人群,Pembrolizumab 采用了联合治疗方式,KEYNOTE-021 G 队列,无论是PD-L1 阳性或是阴性的非鳞NSCLC 中,Pembrolizumab联合培美曲塞/ 卡铂方案都较单用化疗显著提高了疗效,基于该研究,获得了FDA 的快速审批,近期公布的KEYNOTE-189 研究进一步验证了这一结果。同样,在未经PD-L1 选择的鳞癌中,KEYNOTE-407 研究也显示Pembrolizumab 联合卡铂/紫杉醇或白蛋白紫杉醇的疗效明显优于单用化疗,将生存期延长了4 个多月,这对进展非常缓慢的鳞癌来说无疑是一次重大的突破。至此Pembrolizumab 在肺癌领域已经取得了压倒性的优势。
Atezolizumab 作为后起之秀, 与前两者相比疗效也毫不逊色。2016 年10 月, 根据POPLAR 和OAK 研究的结果,Atezolizumab 被FDA 批准二线治疗晚期NSCLC。POPLAR Ⅱ期研究显示,Atezolizumab 对比多西他赛生存期有显著获益,PD-L1 表达越高的患者,生存获益越显著。OAK Ⅲ期研究验证了同样的结果。Durvalumab成为继罗氏Atezolizumab、辉瑞/ 默克Avelumab 之后第3 个抗PD-L1 单抗药物。2017 年ESMO 大会公布了Durvalumab 在肺癌的重磅研究PACIFIC, 接受了至少2 周期以铂类为基础的化放疗后尚未出现疾病进展的NSCLC 患者随机接受Durvalumab 和安慰剂,Durvalumab 显著延长了无进展生存时间11.2 个月,以至于被称为免疫治疗的一场“海啸”。毫无疑问,基于这个研究,Durvalumab 被FDA 批准用于经放化疗治疗后无进展的晚期NSCLC 的治疗。
3.2 黑色素瘤
免疫检查点抑制剂最早在黑色素瘤中研究, 也是最早在黑色素瘤中获批适应证。早在抗PD-1/PD-L1 单抗之前, 另外一种免疫检查点抑制剂抗细胞毒性T 淋巴细胞相关抗原4(cytotoxic Tlymphocyte associated antigen-4, CTLA-4)单抗Ipilimumab 在2011 年获得FDA 批准,成为第一个被批准用于转移性黑色素瘤的免疫治疗药物,从而开启了免疫治疗的全新时代。
2014 年7 月,日本正式批准Nivolumab 在日本上市,用于不可切除的黑色素瘤。Nivolumab成为第一个获批上市的抗PD-1/PD-L1 单抗药物。同年年底,Nivolumab 获得FDA 批准上市,用于经Ipilimumab 或BRAF 抑制剂(BRAF 突变) 治疗后进展的无法手术切除或晚期黑色素瘤患者的二线治疗,此次获批是基于CheckMate 037 研究的结果,Nivolumab 较标准化疗将客观缓解率提高了约20%。基于CheckMate 066 研究, 在初治BRAF V600 野生型患者中,Nivolumab 相比于标准治疗达卡巴嗪延长了生存期, 这让Nivolumab 成为抗PD-1/PD-L1 治疗领域首个获批用于黑色素瘤(BRAF 野生型) 一线治疗的抗PD-1/PD-L1 单抗。2015 年,基于CheckMate 069 研究结果,Nivolumab 联合Ipilimumab 被批准一线治疗BRAF V600 野生型不可切除或转移性恶性黑色素瘤。研究发现, 与Ipilimumab 单药治疗相比,Nivolumab 联合Ipilimumab治疗将BRAF 野生型黑色素瘤患者的客观缓解率提高了将近50%, 无进展生存期延长了约4个月。2016 年,Nivolumab 联合Ipilimumab 的适应证进一步扩大,被批准用于不可切除或转移性恶性黑色素瘤的一线治疗(无论BRAF 突变与否)。获批是基于CheckMate 067 研究, 结果显示,Nivolumab 联合Ipilimumab相比于单药 Ipilimumab, 结果依然很惊艳,而且疗效与预测标志物BRAF 突变情况无关, 与PD-L1 表达水平无关。2017年,FDA 批准Nivolumab 作为经过手术完全切除的淋巴结转移或转移性黑色素瘤患者的单药辅助治疗, 基于CheckMate 238临床研究获批,研究显示在复发风险较高的Ⅲ / Ⅳ期黑色素瘤术后患者中,Nivolumab 辅助治疗优于Ipilimumab 的标准治疗。Nivolumab 相较Ipilimumab 无复发生存率更高,且副作用更少。
2014 年9 月,FDA 根据KEYNOTE-001 研究结果, 加速审批Pembrolizumab 用于不可手术或转移性恶性黑色素瘤的二线治疗。2015 年12 月, 基于KEYNOTE-006 研究结果,Pembrolizumab 的疗效远远优于Ipilimumab, 将客观缓解率提高了约20%,同时延长了患者生存期。因此,FDA 扩大了Pembrolizumab 的适应证, 批准其作为不可切除或转移性黑色素瘤患者一线治疗药物( 无论BRAF 突变与否)。Nivolumab已经取得了辅助治疗适应证,默沙东同样也在这方面布局,KEYNOTE-054 研究显示, 经手术切除的Ⅲ期黑色素瘤患者辅助Pembrolizumab 相比安慰剂组,显著改善了患者的无复发生存期,有望获批上市。
3.3 尿路上皮癌
尿路上皮癌是目前为止获得抗PD-1/PD-L1 单抗适应证最多的瘤种,5 个抗PD-1/PD-L1 单抗在尿路上皮癌都有相应的适应证。
Atezolizumab 虽然在肺癌、黑色素瘤等其他领域落后于Nivolumab 和Pembrolizumab,不过在尿路上皮癌却成为首个获批的免疫检查点抑制剂。2016 年5 月,基于IMVigor 210 研究的一个队列,FDA 批准Atezolizumab作为铂类治疗失败的转移性尿路上皮癌二线治疗。但是Atezolizumab 对比标准治疗的Ⅲ期确证性研究IMvigor 211 却遭遇滑铁卢,研究未能到达主要终点,Atezolizumab 相比化疗没有改善患者的总生存期。2017年4 月,Atezolizumab 又凭借IMVigor 210 研究的另外队列,再次获得FDA 加速批准,用于一线治疗不适合接受铂类药物化疗的晚期尿路上皮癌。
2017 年2月,基于CheckMate 275 研究,FDA 批准Nivolumab用于铂类治疗失败局部晚期或转移性尿路上皮癌的二线治疗。研究结果显示,总体人群的客观缓解率达到19.6%,PD-L1 ≥ 1% 的亚组中位生存期达到11.3 个月。
2017 年5 月,Pembrolizumab同时获FDA 批准用于晚期尿路上皮癌一线及二线治疗的2个适应证。一线获批的适应证基于KEYNOTE-052 Ⅱ 期研究, 结果显示客观缓解率达到29%。二线治疗的获益基于Ⅲ期KEYNOTE-045 研究, 这是首个与化疗头对头相比生存期超过化疗的免疫检查点抑制剂,生存期延长了大约3 个月。
在同年5 月,FDA 也批准了Avelumab 和Durvalumab用于晚期尿路上皮癌二线治疗,Avelumab 的批准基于JAVELIN Ib期研究的尿路上皮癌队列,Durvalumab 的批准基于1108 I/II期研究的尿路上皮癌队列。
3.4 微卫星不稳定的实体瘤
2017 年5 月,FDA 加速批准了Pembrolizumab 用于标准治疗后进展的高微卫星不稳定(microsatellite instabilityhigh,MSI-H) 或错配修复缺陷(mismatch repair deficient,dMMR)的成人和儿童晚期或转移性实体肿瘤患者。这是FDA 首次基于分子标志物而非既往依照肿瘤来源的获批,成为肿瘤药物治疗史上又一个重要的里程碑。该适应证的批准基于5 个临床研究,共纳入15 个瘤种有MSI-H和dMMR 的149 名患者, 其中90 名为结直肠癌。总体人群的客观缓解率达39.6%。结直肠癌患者客观缓解率为36%。

4. 常用标志物
抗PD-1/PD-L1 单抗有“神药” 之称, 囊括了几十种适应证,是否适合所有的患者呢?其实从NSCLC 的二线治疗看,抗PD-1/PD-L1 单抗的治疗缓解率大约在15%~30%,获益人群是比较少的,加之免疫治疗费用昂贵,因此有必要采用标志物筛选出真正合适免疫治疗的患者。目前研究比较多的三大标志物,分别是PD-L1、TMB、微卫星不稳定(microsatellite instability,MSI)和dMMR。
4.1 PD-L1
目前研究最早最多的是PD-L1。肿瘤细胞抑制T 细胞功能的机制之一就是高表达PD-L1,因此理论上认为,PD-L1 表达越高, 疗效越好。临床上大多数研究也证实确实如此。然而,PD-1 表达阴性的一部分患者也能从抗PD-1/PD-L1 单抗中获益, 而且像Nivolumab 的CheckMate 017、CheckMate 026 及CheckMate 227 等研究显示,Nivolumab 与PD-L1 表达并无相关性。此外,还有很多因素影响PD-L1,如肿瘤细胞PD-L1 的表达在疾病的不同阶段发生动态变化,同一个患者原发灶与转移灶PD-L1 表达不同,各家公司采用的检测抗体不一致,PD-L1 阳性界值也不一样等,这些问题尚待解决。因此,PD-L1是目前最常用的一个标志物,但不是最理想的标志物。
4.2 TMB
TMB 是指肿瘤组织每兆碱基中突变的数目,简单地说,TMB越高, 肿瘤的个性特征就越明显,越不同于正常细胞,越容易被免疫细胞识别出来,免疫反应越强,疗效就越好。目前研究显示,无论是被TMB 拯救于水火的Nivolumab,还是Pembrolizumab和Atezolizumab, 都显示TMB与疗效成正相关。但是TMB 同样也存在很多问题,除了与PD-L1一样的检测结果有时间、空间异质性,TMB 的阳性界值不一致。此外,TMB 检测价格昂贵,时间长,解读数据复杂,目前TMB主要用于临床研究。
4.3 MSI 或dMMR
人体细胞中存在一类能修复DNA 碱基错配的安全保障体系,称之为DNA 错配修复(mismatch repair,MMR) 系统。错配修复缺陷(dMMR),顾名思义,就是MMR 修复机制出现故障。MSI 由于MMR 功能缺陷,从而导致微卫星重复序列长度的改变。dMMR的肿瘤细胞较MMR 正常肿瘤细胞更容易累积突变,产生新抗原,容易被免疫系统识别,理论上免疫治疗疗效更好。Pembrolizumab及Nivolumab 的数个研究都显示,抗PD-1/PD-L1 单抗对MSI-H或dMMR 的结直肠癌或其他实体瘤种疗效显著,而对MSI-L 患者基本无效。目前dMMR 标志物研究还比较少,主要集中在结直肠癌,还需在其他瘤种以及其他抗PD-1/PD-L1单抗中进一步研究。
除了上述3 种标志物以外,目前还有一些标志物如POLE 基因突变、新抗原水平、肿瘤浸润的淋巴细胞、EGFR 突变水平等处于研究中。但是令人遗憾的是,没有一个标志物可以明确地告诉患者, 使用抗PD-1/PD-L1 单抗是否有效。不过可以将多个指标联合分析,一方面可以更进一步精选优势人群,提高命中率;另一方面也可以避免仅检测一个指标而错失使用免疫检查点抑制剂治疗的机会。

5. 不良反应及处理
与其他抗肿瘤药物一样,抗PD-1/PD-L1 单抗使用过程中也会伴随发生与其作用机制相关的不良反应,称为免疫相关不良反应(irAE)。与化疗所致的不良事件相比,irAE 可能具有迟发、持续时间长和累及器官多的特点。irAE 主要分为常见的免疫相关皮肤毒性、内分泌疾病、肝脏毒性、胃肠道毒性、肺炎以及罕见的免疫相关毒性如神经系统毒性、心脏毒性、风湿免疫毒性、肾毒性、眼毒性等。irAE 发生时间尚无明显规律可循,irAE 可在给药后的几天至几个月内发生,皮肤反应为最先发生的irAE。irAE 的严重程度可以从无症状到严重甚至危及生命。联合治疗时,可能会增加irAE 的严重程度。
大部分的irAE, 如果早期发现和早期治疗,都可以得到有效控制,因此需要对患者加强教育及定期监测以发现任何可能发生的irAE 并及时给以相应的处理。irAE 的处理可参照美国临床肿瘤学会(ASCO)联合美国国立综合癌症网络(NCCN)发布的免疫治疗相关不良反应管理指南[7,8]。
对于1 级毒性(除一些神经、血液学和心脏毒性以外),在密切监视下继续接受免疫治疗;对于大多数2 级毒性, 可能需要暂停免疫治疗,当不良事件恢复至1 级或1 级以下时考虑继续治疗, 可能需要使用皮质类固醇;对于3 级毒性,停止免疫治疗,并开始使用大剂量的皮质类固醇。如果在接受大剂量的皮质类固醇治疗48~72 小时后症状仍没有缓解,那么可能需要使用免疫抑制剂。不良事件恢复至1级或1 级以下时,可再次使用免疫检查点抑制剂,但如果再次出现相应的毒性,需永久终止免疫治疗;对于4 级毒性,除了使用皮质类固醇治疗或免疫制剂,可能需要永久中止使用免疫检查点抑制剂治疗。
总之, 抗PD-1/PD-L1 单抗发展如火如荼、方兴未艾,一路披荆斩棘,制药公司、医务人员甚至患者都为之疯狂。确确实实给很多瘤种的治疗带来了质的飞跃,为患者带来重生的希望。但同时也要注意抗PD-1/PD-L1单抗并非万能神药,获益人群是有限的,而且有潜在的危害,严重的甚至危及生命,临床应用还需慎重选择。
作者简介
赵新汉,医学博士,西安交通大学第一附属医院肿瘤学二级教授,一级主任医师,博士研究生导师,博士后导师,西安交通大学第一附属医院长安区医院院长。近年来重点从事肿瘤相关基因的基础与临床研究,主持国家自然科学基金项目5项,主持陕西省“13115”科技创新工程重大科技专项项目1 项,教育部博士点基金1 项,吴阶平医学基金会临床科研专项资助基金2 项。发表科研论文100 余篇,其中SCI收录50余篇。

本文参考文献请扫描二维码查阅
来源:赵新汉.肿瘤免疫治疗明星药──抗PD-1/PD-L1 单克隆抗体[J].中国食品药品监管.2018.10(177):35-41
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













